Les Télomères
Les télomères, une piste pour ralentir le vieillissement cellulaire.
Les télomères jouent un rôle majeur dans le vieillissement de notre organisme. Nombreuses publications scientifiques qui ont soulignées l’importance de garder les télomères intacts pour ralentir le vieillissement, vivre longtemps et en bonne santé. Les cellules du corps formés par les télomères et organes ont une durée de vie maximale génétiquement programmée, mais ce processus peut être accéléré par la dépression, le stress, le manque de sport, la mauvaise alimentation, la consommation de drogues et tabacs .Les télomères se définissent comme étant une partie de l’ADN, se trouvant au bout des chromosomes.Ces extrémités de l’ADN sont chargés de la conservation du matériel génétique, ainsi que de la protection des chromosomes. Un télomère court est, en fait, lié à un risque plus élevé de contracter des maladies dégénératives, de développer des cancers et de vieillir plus vite.
Le raccourcissement progressif du télomère et sa dégradation à chaque division cellulaire sont normalement inhibés par la Télomérase. Ce dernier la télomérase est une enzyme, dont le rôle consiste à conserver la longueur du chromosome en ajoutant à son extrémité une structure spécifique, ou rallonge le télomère dans des termes plus clairs.Pour différentes raisons, l’activité de la télomérase peut s’affaiblir ; ce qui favorise la perte des télomères.

DR Elizabeth Blackburn, biologiste moléculaire américaine prix Nobel de médecine : explique sa théorie pour vivre plus longtemps et en bonne santé.
Lauréate du prix Nobel de médecine pour ses découvertes importantes dans le domaine du vieillissement cellulaire, le Docteur Elizabeth Blackburn , dans cette vidéo exclusive, la biologiste moléculaire nous fait entrer dans l’univers microscopique des “télomères” et de la ”télomérase”, acteurs essentiels de la protection de l’information génétique, et nous transmet des pistes précieuses pour vivre plus longtemps en bonne santé.
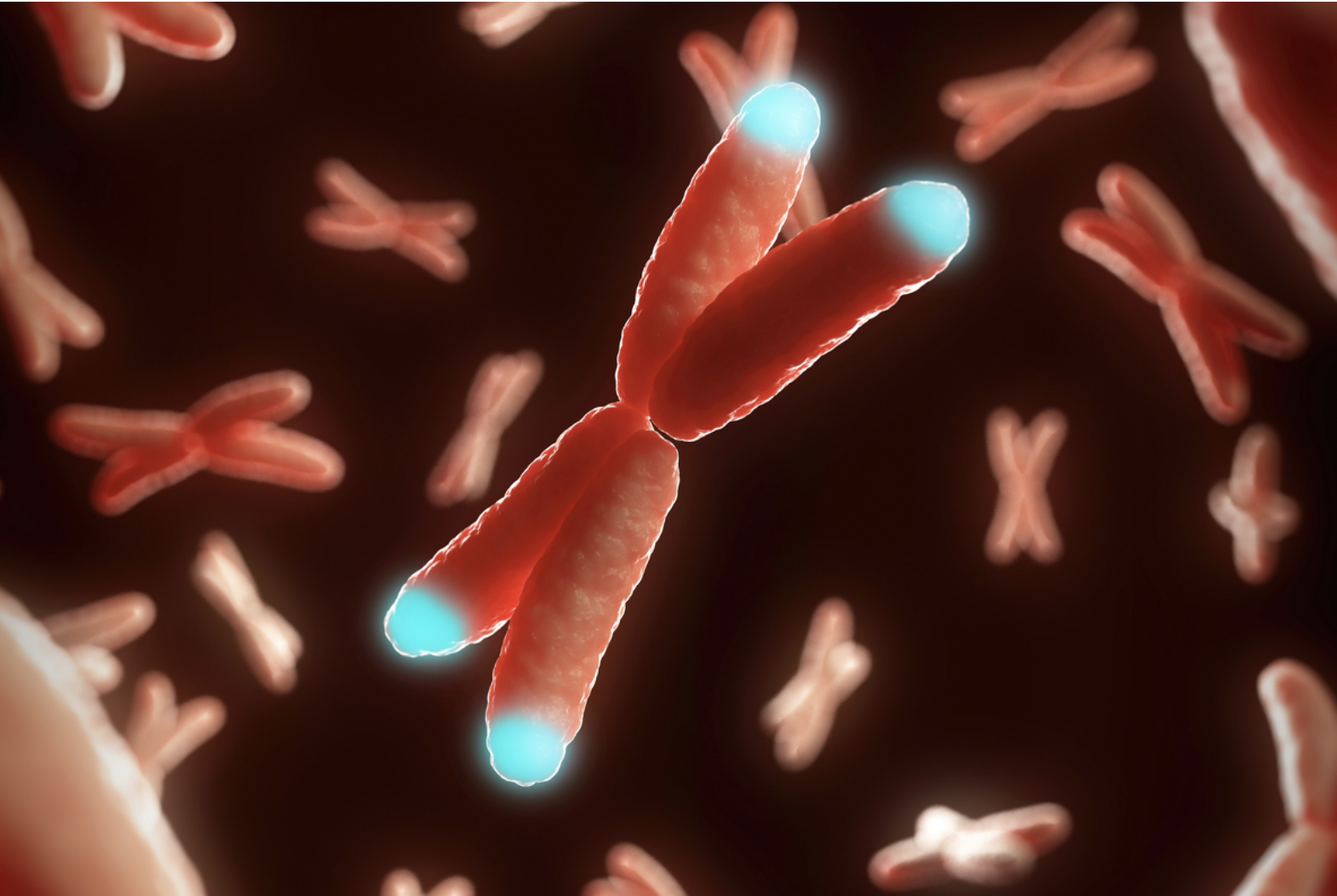
ADN ET TELOMERES
ADN, et télomères

Nombreux sont les scientifiques qui ont démontré que le raccourcissement des télomères diminue l’espérance de vie.
Des télomères courts, se traduisent par un vieillissement prématuré de la peau et des phanères, avec une atteinte de la moelle osseuse et du système immunitaire. Les auteurs de l’étude ont remarqué que les sujets ayant des télomères très courts présentaient une espérance de vie relativement faibles et des risques très élevés de contracter des maladies infectieuses.
Selon les scientifiques la mauvaise alimentation, la pollution, l’alcool, les médicaments, le tabac accélèrent le processus du vieillissement et donc l’apparition des rides ainsi q’un affaiblissement de nos défenses antioxydantes (vitamines, oligoélé- ments) mais aussi à l’apparition de dégâts cellulaires non désirables. L’alimentation actuelle n’est plus suffisamment saine et équilibrée, et qu’elle nous apporte de moins en moins d’antioxydants naturels
Selon 5 études publiées sur le sujet, la consommation de fruits et légumes est associée à de plus longs télomères. L’alimentation influerait sur l’âge biologique (la longueur des télomères) et serait donc une des clefs de l’anti-âge.
Certaines études indiquent cependant des associations défavorables entre certains groupes d’aliments et la longueur des télomères : céréales, viandes transformées, boissons sucrées, gras et huiles. En ce qui concerne les habitudes alimentaires, seul le régime méditerranéen a été associé à des télomères plus longs. Ce régime alimentaire riche en fruits et légumes est bénéfiques pour le maintien des télomères et ralentit le processus de vieillissement cellulaire.

L’organisme entame naturellement le processus de vieillissement avec l’âge : c’est génétiquement programmé. En effet les cellules sont destinées à se répliquer un certain nombre de fois. À chaque réplication, les chromosomes raccourcissent au niveau des télomères, à savoir l’extrémité des brins d’ADN. Présents à l’extrémité des chromosomes, les télomères assurent la protection de l’ADN. Avec l’âge, ces structures se raccourcissent, ce qui expose l’organisme à de nombreuses complications. Plusieurs études ont montré que ce raccourcissement des télomères était associé au vieillissement cellulaire, à l’apparition de certaines maladies liées à l’âge et à la réduction de l’espérance de vie.
Lorsque ces télomères atteignent une certaine longueur, ils ne sont plus capables d’assurer leur rôle de protection correctement. La cellule en question interprète cette situation comme une détérioration de son ADN. Son processus de multiplication est donc interrompu, et elle entre en sénescence, puis meurt. C’est l’apoptose, ou mort cellulaire programmée.
Les cellules ne peuvent pas gérer ce raccourcissement au-delà d’un certain “quota” : l’ADN cesse de se répliquer, et la cellule avec. C’est le processus de mort cellulaire qui se déclenche. La cellule change de morphologie et convoque le système immunitaire, qui fait en sorte de l’éliminer. La mort des cellules entraîne de façon plus globale celle des tissus, et endommage l’organisme progressivement. Ce procédé fait partie du cycle naturel de l’organisme, mais d’autres mécanismes expliquent le vieillissement prématuré.

Le stress oxydatif est très souvent pointé du doigt comme un phénomène néfaste pour l’organisme. Mais quel est le mécanisme mis en jeu ?
Le processus d’oxydation qui a lieu dans les cellules entraîne la formation de molécules instables, à qui l’oxydation ôte un électron. Les molécules, alors dotées de radicaux libres, cherchent à retrouver leur stabilité et arrachent à leur tour un électron à une autre molécule environnante. Cela donne rapidement lieu à une réaction en chaîne, à laquelle l’organisme ne sait pas toujours faire face.
Le corps est équipé de composés naturellement antioxydants, ces composés, sont glutathion, des enzymes (peroxydases, catalases, superoxyde dismutases…), les vitamines C et E … Lorsqu’ils ne suffisent plus, l’attaque des radicaux libres se transforme en stress oxydant. Ce stress, avec la réaction en chaîne qui l’accompagne, entraîne une dénaturation des protéines, des lipides, et globalement de toutes les molécules qui structurent et font fonctionner l’organisme. Les organes, la peau, le système nerveux et cardiovasculaire, tout l’organisme souffre de ce stress oxydatif, et vieillit prématurément.
Si l’oxydation est déjà présente naturellement dans le corps, de nombreux éléments extérieurs aggravent le stress oxydant. Le tabac, l’alcool, une alimentation pauvre en légumes et fruits, la pollution, les rayons du soleil, le stress…
La glycation est un phénomène qui prend de plus en plus d’importance dans la recherche contre le vieillissement. C’est un mécanisme au cours duquel un sucre se fixe sur une protéine, créant des protéines glyquées. Elle a d’autant plus lieu que l’organisme est surchargé de sucre, c’est pourquoi on l’observe en particulier chez les personnes diabétiques. Les protéines glyquées, à terme, donnent ce que l’on appelle les produits terminaux de glycation ou PTG (AGE en anglais) : ce sont ces derniers qui sont impliqués dans le vieillissement prématuré. Ils provoquent des modifications structurelles, notamment dans les tissus cutanés, entraînant un relâchement de la peau.
Ils ont aussi des conséquences sur la paroi des vaisseaux, sur les cellules musculaires, sur les globules blancs… En bref, c’est le corps tout entier qui pâtit de cette glycation excessive. Pour couronner le tout, les PTG ne sont pas dégradés par l’organisme, et n’ont d’autre choix que d’être éliminés naturellement par les reins. Mais ceux-ci ne peuvent pas faire face à une glycation excessive, ce qui entraîne l’accumulation des résidus néfastes. Encore une cascade de réactions qui favorise le vieillissement prématuré.
Explication les mécanismes des télomères

Point de vue scientifique
Les conséquences du vieillissement sont connues de tous:
Creusement des rides, courbure du dos, blanchiment des cheveux…
Elles peuvent aussi être moins évidentes, mais pathologiques : cancers, maladies neurodégénératives, cardiovasculaires. Pour ralentir le processus de vieillissement, il est naturellement conseillé d’adopter une hygiène de vie raisonnable.
- Une alimentation équilibrée et riche en antioxydants, une activité physique régulière, un sommeil de qualité permettent de limiter le stress oxydatif et la glycation démesurée.
- Il est aussi fortement conseillé de limiter la consommation d’alcool et de bannir le tabac.
Il est également possible d’aller plus loin, en assimilant des composés appelés les sénolytiques. Ces molécules sont actuellement sous la loupe des chercheurs, curieux d’en savoir plus sur leurs capacités à ralentir le vieillissement cellulaire. Mais quelques-uns de ces composés naturels sont déjà bien connus :
- La restriction calorique et les modifications génétiques sont des modèles expérimentaux qui permettent d’accroître chez l’animal la durée de vie maximale. Nous avons vu que ces deux stratégies semblent être liées avec la piste du stress oxydant, ce qui revient à attribuer un intérêt potentiel aux antioxydants comme agents aptes à retarder le vieillissement. Jusqu’à présent, seuls des résultats tangibles ont été obtenus avec le déprényl. Une grande quantité de travaux ont montré que l’administration de cette molécule permet d’augmenter significativement la durée de vie chez de nombreuses espèces animales.
L’action du déprényl, un inhibiteur de la monoami- neoxydase B (MAO B), est liée à une action antitumorale, mais aussi à sa capacité d’augmenter les activités de la SOD et de la catalase dans différentes régions du cerveau. Récemment, il a été montré qu’une autre substance à activité antioxydante, le N-tertbutyl- alpha-phénylnitrone (PBN), un “spin trap” utilisé pour la mise en évidence des radicaux libres par résonance paramagnétique électronique, est aussi capable d’augmenter la durée de vie chez certains petits animaux.
Un traitement par des composés chimiques, mimant des activités SOD et catalasiques permet d’augmenter la durée moyenne de vie de 44 %. Par contre, toutes les études visant à démontrer qu’un apport nutritionnel en antioxydants classiques (vitamines) permet d’accroître l’espérance de vie ont jusqu’à présent échoué.
- Les antioxydants nutritionnels (vitamines, oligoéléments) ont néanmoins un rôle à jouer dans l’amélioration de la qualité de vie en réduisant les risques de maladies associées au vieillissement (maladies cardiovasculaires et neuro-dégénératives, cancer, diabète, etc.). Par exemple, il est bien connu que le processus du vieillissement est associé au déclin des fonctions immunitaires régulées par le zinc.
- De façon plus spécifique, le vieillissement se traduit par une diminution du nombre total de lymphocytes et de la production d’interleukine 2 (IL-2), un facteur de croissance nécessaire pour le maintien de la prolifération des cellules T. Les sujets âgés sont ainsi plus sensibles à des maladies infectieuses ou diverses maladies, comme la leucémie, différentes formes de cancer et des phénomènes autoimmuns. Chez les sujets âgés, un apport exogène d’un cocktail de multivitamines permet de stimuler le système immunitaire en augmentant le nombre total de cellules T circulantes, le nombre de cellules T helpers (CD4+) et le rapport cellules CD4+ helpers / CD8+ cytotoxiques (1). Dans le même ordre d’idées, Meydani et al. (34) ont montré qu’un apport en vitamine E chez des sujets âgés est capable d’augmenter le taux plasmatique d’IL-2 et de diminuer les taux plasmatiques de peroxydes lipidiques.
Un grand nombre d’études montre que des taux sanguins faibles en antioxydants sont étroitement liés à une augmentation de l’apparition de maladies cardiovasculaires ou de cancer.
- La quercétine, un flavonoïde que l’on retrouve dans les câpres, l’oignon rouge, le..
- Le collagène, protéine indispensable au derme pour une peau souple.
- La fisétine, un autre flavonoïde présent à l’état naturel dans les fraises et les mangues, par exemple.
Adopter un mode vie sain, c’est à dire bien s’alimenter, faire de l’exercice, gérer son stress et ne pas fumer ni consommer trop d’alcool, a des effets bénéfiques sur le vieillissement de nos cellules selon la littérature scientifique récente. Un des phénomènes bien documentés qui survient lors du vieillissement cellulaire est la dégradation des télomères, des structures uniques qui se trouvent aux extrémités de chacun de nos chromosomes ; or un mode de vie sain permet de ralentir ce processus. L’entraînement physique permet d’améliorer plusieurs aspects de la santé humaine, incluant la capacité à faire de l’exercice, la régulation de la pression artérielle, la sensibilité à l’insuline, le profil lipidique, la réduction du gras abdominal et de l’inflammation.
Dépression et vieillissement
Les personnes atteintes de dépression sévère, y compris dans le passé, présentent des signes de vieillissement cellulaire précoce. Les chercheurs planchent sur les moyens d’inverser la tendance.
C’est un effet collatéral méconnu de la dépression. La forme sévère de cette maladie psychiatrique fait vieillir plus vite les cellules des malades, révèlent des chercheurs du département de psychiatrie de l’université VU Medical Center d’Amsterdam dans une étude publiée dans la revue Molecular Psychiatry. Un lien suspecté depuis longtemps mais qui a cette fois été montré au niveau chromosomique et que les scientifiques tentent désormais d’inverser.
On savait déjà que les dépressifs développent davantage de pathologies liées à l’âge comme le diabète de type 2, des démences ou des cancers. Leur mauvaise hygiène de vie est en partie incriminée (manque d’exercice physique, mauvaise alimentation, consommation d’alcool et/ou de tabac) mais cela ne suffit pas à expliquer ce phénomène. Les chercheurs suspectaient donc un mécanisme biologique indépendant, lié à la dépression.
Ralentir le veillissement
Le processus de vieillissement cellulaire peut être ralenti par l’exercice soutenu. Une étude publiée en 2009 a montré que l’entraînement physique soutenu chez de jeunes athlètes ou des athlètes d’âge moyen était associé à une plus grande activité de la télomérase, à l’expression accrue de protéines stabilisatrices des télomères, et à des télomères plus longs, comparé à des personnes sédentaires.
Le même groupe de recherche a réalisé récemment un essai randomisé contrôlé afin de démontrer directement que l’exercice physique est la cause de l’augmentation de l’activité de la télomérase et de la longueur des télomères. Les résultats de l’étude ont été publiés en 2018 dans la revue European Heart Journal. Les chercheurs ont recruté 124 hommes et femmes d’âge moyen (≈50 ans) qui étaient en bonne santé, mais qui ne faisaient pas d’exercice physique. Durant les six mois de l’étude, les participants ont été divisés au hasard en quatre groupes : un groupe témoin et trois groupes qui ont fait différents types d’exercices 3 fois par semaine ; un groupe a fait de l’exercice d’endurance (marche/course à pied, 45 min/jour) ; un autre groupe a fait de l’exercice par intervalles de haute intensité (4 min à haute intensité/4 min de repos, répété 4 fois) ; et un autre groupe a fait des exercices de résistance (divers appareils de musculation). Des prises de sang ont été effectuées avant, durant et à la fin de l’étude, afin de mesurer la longueur des télomères et l’activité de la télomérase dans les leucocytes (globules blancs).
À la fin de l’étude, les personnes qui ont fait de l’exercice, peu importe le type, avaient une meilleure capacité cardio-respiratoire qu’au début de l’étude. L’activité de la télomérase était 2-3 fois plus élevée dans les leucocytes des personnes qui ont fait de l’exercice d’endurance ou par intervalles, par comparaison au groupe témoin. Par contre, cet effet n’a pas été observé chez les personnes qui ont fait des exercices de résistances (musculation). De même, la longueur des télomères était plus grande chez les personnes qui ont fait de l’exercice d’endurance ou par intervalles, mais pas chez les personnes qui ont fait des exercices de résistances.
Source: Dr Martin Juneau, M.D., FRCP
Cardiologue et Directeur de la prévention, Institut de Cardiologie de Montréal. Professeur titulaire de clinique, Faculté de médecine de l’Université de Montréal.

Corrélation entre cancers et télomères courts
L’instabilité génétique associée aux dysfonctionnement et raccourcissement du télomère encourage le développement des cancers, selon des chercheurs. Dans ces quatre études, entre autres, les scientifiques ont étudié la relation entre la longueur des télomères et les différentes formes de cancer. Les quatre expériences ont été menées sur des groupes de patients souffrant de divers types de cancer, dont 92 de cancer du cou et de la tête, 135 de cancer de la vessie, 54 de cancer du poumon et 32 de carcinome de cellules rénales.
La longueur de leurs télomères, l’instabilité génétique et l’importance des dommages de l’ADN ont été évalués au test des comètes (comet assay en anglais). D’autres examens ont été aussi effectués pour déterminer l’importance de leurs maladies. Les résultats des analyses réalisées chez chaque groupe ont montré que les sujets avec des télomères courts développent d’importants cancers. En effet, lorsque la longueur de ces télomèresatteint la limite critique alors que la division cellulaire se poursuit encore, l’activation automatique du mécanisme de réparation de l’ADN dans la cellule entraîne une instabilité génomique propice à l’oncogenèse (formation d’un cancer).

Le raccourcissement des télomères au fil des âges a aussi un impact sur les ostéoblastes , les cellules responsables de la synthèse de la partie non minérale des os. D’après certaines publications scientifiques, au cours de cet examen réalisé sur 2 150 femmes, il a été constaté que celles qui avaient des télomères courts ont été plus sujettes au développement d’une ostéoporose.
La faible activité de la télomérase et la perte de télomères ont conduit à une baisse progressive de la densité osseuse, au vieillissement des ostéoblastes et à la sécrétion accrue de cytokines pro-inflammatoires qui encouragent la dégradation des tissus. Les auteurs de cette revue ont conclu que la longueur des télomères constitue un marqueur biologique du vieillissement des os.
Solutions
Différentes solutions sont avancées par les scientifiques, pour protéger les télomères d’une dégradation accélérée due à une mauvaise hygiène de vie ou liée à l’âge :
- Cycloastragenol : C’est la seule molécule connue jusque-là comme étant capable de maintenir longtemps l’intégrité structurale des télomères de l’ADN et d’activer en même temps la télomérase. Les expériences scientifiques qui ont mis en évidence les qualités thérapeutiques de ce principe actif de l’Astragalus membranaceus sont nombreuses, dont voici l’une des plus notables. Cette étude a été menée sur une marque connue de cycloastragenol, le TA-65 des laboratoires TA Sciences. Pendant 12 mois, 117 sujets âgés de 53 à 87 ans infectés de virus cytomégalovirus ont administré une faible dose de TA-65 (250 U) par jour. Cette maladie infectieuse est asymptomatique dans 90 % des cas, mais peut se compliquer chez les sujets dont le système immunitaire est faible. La prise de TA-65 en complément à l’alimentation a permis de maintenir la longueur de leurs télomères. Le cycloastragenol a le pouvoir de protéger les télomères et de les rallonger.
Comparés aux sujets qui ont pris cette molécule, les patients uniquement soumis aux placebos ont présenté des télomères très courts à la fin du traitement.
- Antioxydants : Des scientifiques ont avancé les bienfaits d’un régime alimentaire enrichi en antioxydants pour garder les télomères. Dans cette étude réalisée sur une durée de 5 ans, les participants qui ont pris chaque jour des aliments gorgés d’oméga-3, de vitamines E et C, ainsi que de bêta-carotène, ont présenté des télomères plus longs que le reste du groupe soumis à un régime normal. Les antioxydants protègent, en effet, la cellule et tous ses composants des effets délétères des radicaux libres.
- L’alimentation de qualité rallonge les télomères : Les restrictions alimentaires, le jeûn ou tout simplement le fait de manger moins que d’habitude régulièrement ont aussi un impact positif sur la longévité et la longueur des télomères. Chez des souris de laboratoires, un régime très pauvre en protéines a conduit à une augmentation de leur durée de vie, jusqu’à plus de 66 %. Les rongeurs testés faisaient plus jeunes que leurs âges, et leurs télomères étaient intacts. Les scientifiques ont conclu que l’altération de l’ADN et la charge oxydative sont moins importantes chez les sujets soumis à des restrictions alimentaires.
- Faire du sport chaque semaine : Il faut également faire des activités physiques régulièrement pour maintenir la longueur de ses télomères. Les exercices permettent, en effet, de brûler les graisses nocives aux cellules et éliminer les toxines de l’organisme. Cette revue scientifique a parlé de l’effet du sport sur le stress oxydatif et la dégradation de l’ADN. D’après les observateurs, l’activité de la télomérase et la longueur des télomères des athlètes sont plus importantes que celles des individus ne pratiquant aucun exercice physique. Le sport réduit non seulement le stress oxydatif, mais augmente en même temps l’expression de certaines protéines chargées de préserver la structure des télomères.
Références
(1) Collado M et al. « Sénescence cellulaire dans le cancer et le vieillissement ». Cell, 2007; 130 (2): 223-233.